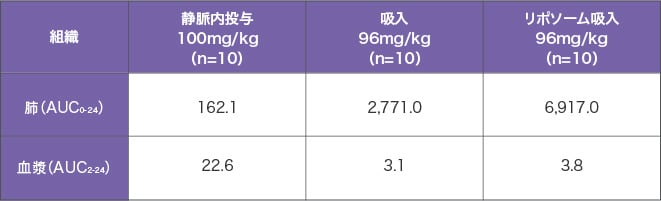
ラットを用いて各種投与法によるアミカシンの肺と血漿の AUC を比較したところ、リポソーム吸入の方が、血漿よりも肺での AUC が 1,800 倍以上大きく、静脈内投与やアミカシンの吸入と比べて肺と血漿の差が大きいことが示されました1)。
※タップすると画像が拡大します。
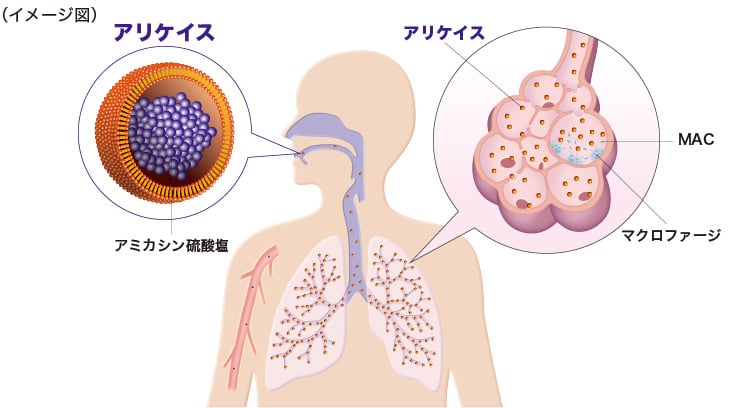
アミカシンの各種投与法による肺と血漿AUCの比較(ラット)
| 組織 |
静脈内投与
100mg/kg
(n=10) |
吸入
96mg/kg
(n=10) |
リポソーム吸入
96mg/kg
(n=10) |
肺
(AUC0-24) |
162.1 |
2,771.0 |
6,917.0 |
血漿
(AUC2-24) |
22.6 |
3.1 |
3.8 |
※タップすると画像が拡大します。
注:データは平均値(単位は論文に記載なし)として示した
Zhang J, et al. Front Microbiol. 2018; 9: 915.
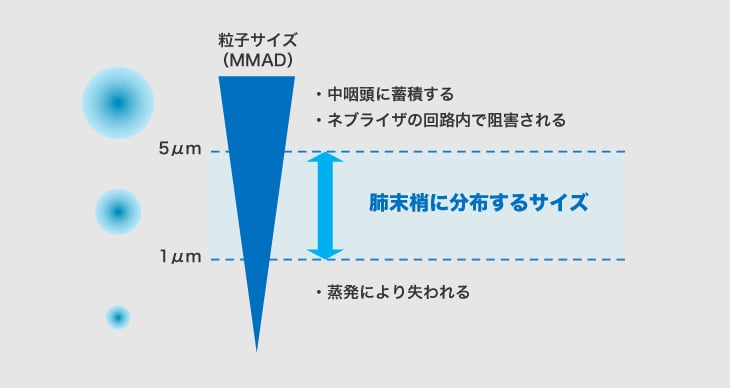
肺MACの感染部位である肺末梢の肺胞まで吸入薬が送達されるためには、吸入薬のエアロゾル粒子のサイズが重要です。粒子サイズが大きすぎるとネブライザ内や中咽頭でひっかかり、肺胞まで届きません。一方、粒子が小さすぎると蒸発してしまいます2)。
一般的に肺の末梢まで薬剤が届くためには、エアロゾルのサイズ(MMAD:mean mass aerodynamic diameter)が1~5μmの間でなければならないとされています2)。
MMADは、吸入薬とネブライザの組み合わせによって変わります。アリケイス®は、in vitro試験において、ラミラ®により生成されたエアロゾルのMMADが平均3.60μmであり、エアロゾルの73.9%が5μm未満であったことが報告されています3)。
エアロゾル粒子の大きさと肺への送達
※タップすると画像が拡大します。
Wenzler E, et al. Clin Microbiol Rev. 2016; 29: 581-632.より作成
ラミラ®(PARI eFlow)により生成されたアリケイス®のエアロゾル粒子のサイズ(in vitro)
|
MMAD
(μm) |
RF(respirable fraction)
(<5.0μm)
(%) |
平均値
(SD) |
3.60(0.19) |
73.9(3.9) |
※タップすると画像が拡大します。

n=3
Li Z, et al. J Aerosol Med Pulm Drug Deliv. 2008; 21(3): 245-254.より作成